2017年7月3日,硕士研究生巩凤芹和李倩同学在组会上做了文献报告,具体内容如下:
报告人:巩凤芹报告题目:Understanding and Overcoming the Limitations of Bacillus badius and Caldalkalibacillus thermarum Amine Dehydrogenases for Biocatalytic Reductive Amination
报告内容:
1. 使用氨作为唯一氨基供体的酮的直接不对称还原胺化反应是化学催化和生物催化两个研究领域的热点,通过对氨基酸脱氢酶进行酶工程改造来得到胺脱氢酶的方法已经成为合成手性胺的有力工具。
2. 目前大多数酶的低底物负载量(<80mM)限制了其在工业上的广泛应用,主要限制因素有以下几点:
(1) 酶在反应体系中的稳定性(2) 底物和产物抑制(3) 不利的平衡反应(4) 催化参数
本文对来自Caldalkalibacillus thermarum的苯丙氨酸脱氢酶进行了酶工程改造,获得了高热稳定性的胺脱氢酶Cal-AmDH,并通过该酶在双相反应体系中进行还原胺化400mM苯氧基-2-丙酮,获得了96%的转化率和ee(R)>99%。
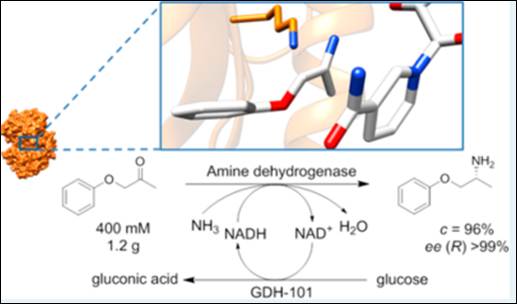
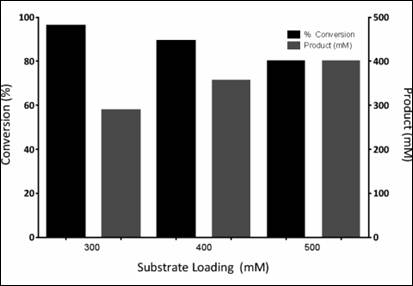
同时,对来自Bacillus badius的苯丙氨酸脱氢酶进行酶工程改造,得到胺脱氢酶Bbad-AmDH,并对两种酶进行了产物抑制的研究:
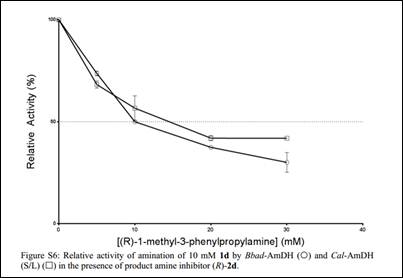
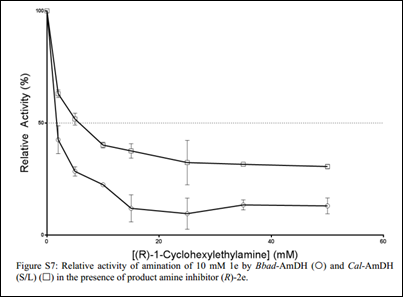
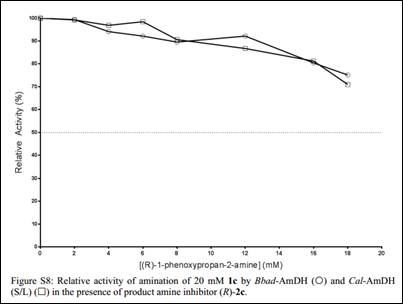
通过测定两种酶的表观IC50发现2d和2e存在不同程度的产物抑制现象,有趣的是,即使1c是优势底物,也存在活性下降的现象。文章进而比较了在加入助溶剂的情况下,两种酶以不同的形式对其优势底物的转化情况:
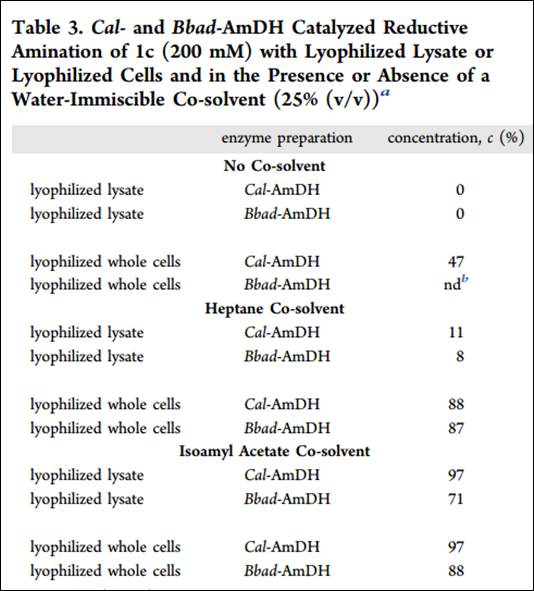
结果显示Cal-AmDH具有更好的转化率,推测是由于其具有更高的稳定性的原因。最后,文章通过分子对接和动力学模拟的技术验证了酶转换数低的问题,并通过分子计算的方法更好的实现了酶分子的诱变方案。
报告人:李倩题 目:Novel α-L-Fucosidases from a Soil Metagenome for Production of Fucosylated Human Milk Oligosaccharides
报告内容:本文作者来自丹麦科技大学,于2016年1月发表在PLOS ONE。本文介绍了一种新型α-L-岩藻糖苷酶,并对其通过催化转糖基作用生产岩藻糖化人乳寡糖的能力进行了评估。本文作者通过功能筛选土壤来源的宏基因组文库,鉴定了7个新型α-L-岩藻糖苷酶基因,并将其在大肠杆菌中表达,对其水解活性、底物特异性以及转糖基能力进行了研究。
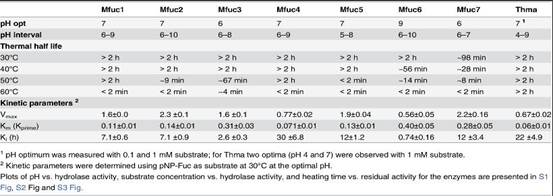
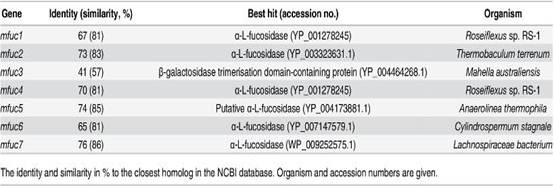
1.利用试剂盒筛选得到7个α-L-岩藻糖苷酶基因,并将其与已知的α-L-岩藻糖苷酶基因相似性做了比对。其中Mfuc3为41%;其他为65% ~ 76%;
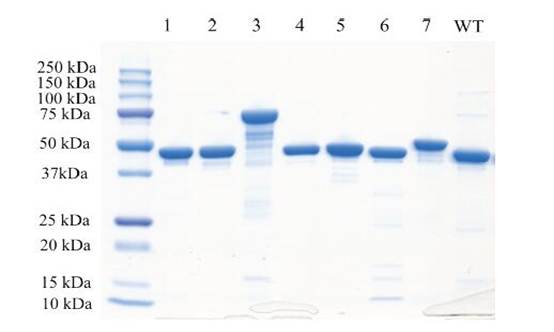
2.将获得的酶基因进行表达纯化,其中Mfuc3分子量为75.6 kDa;其他酶分子量为47.3 ~ 52.2 kDa;
3.筛选得到的酶为GH29家族,为了评估筛选得到的酶与GH29家族代表酶的序列差异性,构建了系统发育树。
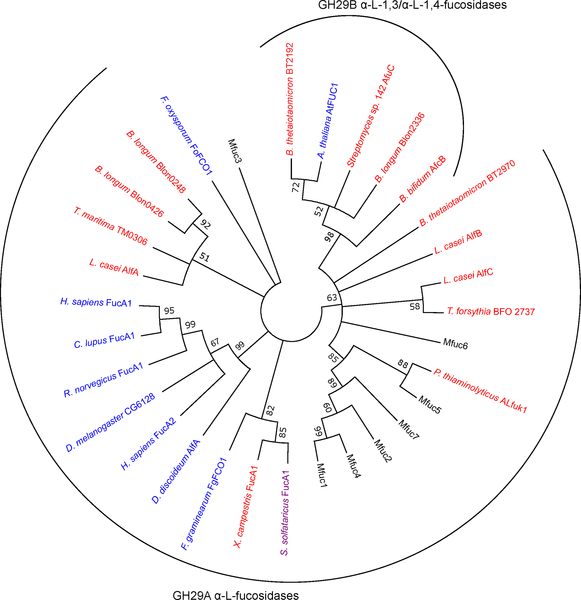
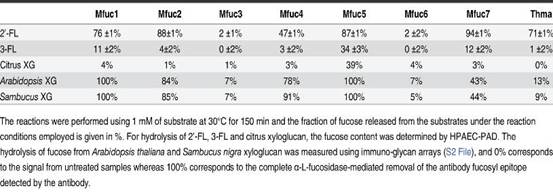
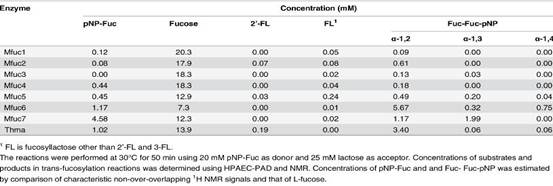
4.作者进一步对7种酶的酶学性质、底物特异性及转糖基能力做了研究。