2017年11月22日,硕士研究生谢尚强同学在组会上做了文献报告,具体内容如下:
报告人:谢尚强 报告题目:PatB1is an O-acetyltransferase that decorates secondarycell wall polysaccharides
主要内容:包括炭疽芽孢杆菌在内的病原体蜡样芽孢杆菌组的次生细胞壁多糖(SCWP)的O-乙酰化对于将表面层(S层)蛋白正确连接到其细胞壁至关重要。本研究通过使用多种假底物和SCWP的化学合成类似物,鉴定了PatB1在蜡样芽孢杆菌中具有SCWPO-乙酰基转移酶的功能。另外作者还报告了PatB1的晶体结构,提供了该酶的机制的详细见解并且定义了SGNH家族的酯酶和脂肪酶的新亚家族,并且提出了SCWP的O-乙酰化模型:PatA1和PatA2将从细胞质来源的乙酰基团转移到质膜上,随后通过PatB1转移至膜结合的SCWP的倒数第二个氨基糖残基上,SCWP的O-乙酰化修饰使得S层发生正确组装。
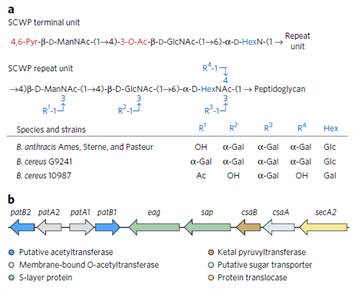
Figure 1 Structure of SCWP from the Bacillus cereus groupand organization of genes involved in its modification
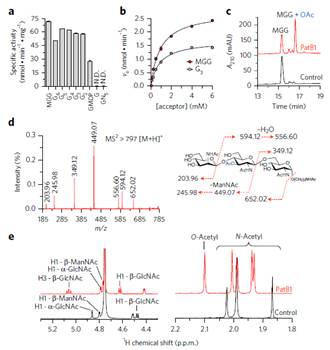
Figure 2 Enzymatic characterization of PatB1 as a SCWPO-acetyltransferase.
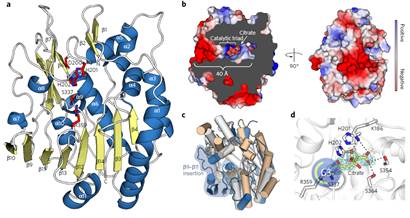
Figure 3 Structure of PatB188–396
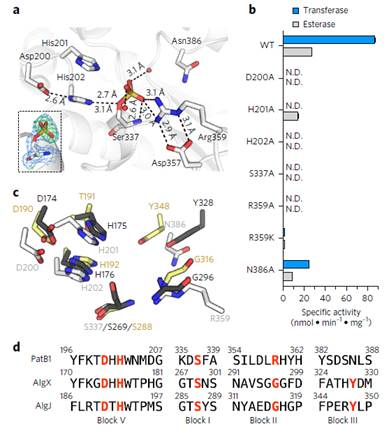
Figure 4 Identification of catalytic and oxyanion holeresidues
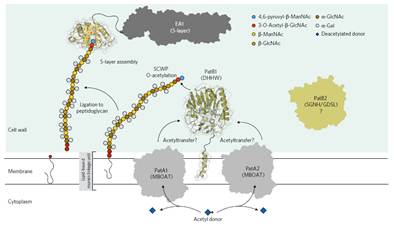
Figure 5 Proposed model for the O-acetylation of SCWPin the Bacillus cereus
结论:(1)作者首次表征来自蜡状芽孢杆菌的PatB1和PatB2的生化和结构表征,并鉴定PatB1为SCWPO-乙酰转移酶。
(2)解析了PatB1的晶体结构,揭示了Ser-His-Asp催化三联体位于死端活性位点裂缝中的。解释了PatB1的具有外切作用,能特异性O-乙酰化修饰SCWP末端β-GlcNAc残基。
(3)提出了SCWP的O-乙酰化模型:来自未知细胞质来源(推测为乙酰-CoA)的乙酰基通过PatA1和PatA2蛋白转移到细胞质膜,随后通过PatB1转移至膜结合的SCWP的倒数第二个氨基糖残基上,SCWP的O-乙酰化修饰使得S层发生正确组装。