酪氨酸酶是一种具有单/双酚氧化酶活性的双功能酶,其在工业上可以用于酶法催化合成邻苯醌和儿茶酚类化合物,用于医药、环境、化工、传感器、材料等多个领域。但已报道的酪氨酸酶的双酚酶活性往往远大于其单酚酶活性,从而限制其应用,因此开发具有相对较高单酚酶活性的酪氨酸酶具有重要的科学和应用价值。
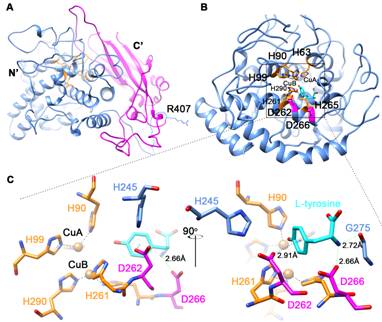
研究组近期针对此问题开展研究工作,成功在大墩榛蘑中克隆到一个酪氨酸酶(AoTyr)基因,并在大肠杆菌中进行了重组表达,得到的重组蛋白经过纯化和活化后进行了酶学性质的表征和酶动力学参数的测定,发现该酶的单/双酚酶活性基本相当,并且这两种酶活均具有底物抑制效应。为了阐明活性中心关键氨基酸残基(D262和D266)对酶活以及底物抑制效应的影响,本研究设计了3个不同的突变体,针对这3个突变体的酶学研究发现,这两个天冬氨酸残基的侧链基团都能影响酶的活性和底物抑制效应,并且当D262突变成天冬酰胺残基后,突变体的酶活大幅降低,但是其单酚酶:双酚酶的催化效率比值却是野生型酶的1.63倍,提示该残基在调控单/双酚酶活性上的重要作用。相关研究结果已申请专利并于近日发表于应用微生物学领域知名期刊Applied and Environmental Microbiology(https://aem.asm.org/content/early/2021/03/15/AEM.00275-21.long)。
该项研究为酪氨酸酶的底物抑制效应提供了新的实例,同时为后续AoTyr的进化改造提供了基础,有望获得酶活大幅提高,并且保持高的单酚酶:双酚酶催化效率比值的改造酶,应用于儿茶酚等化合物的工业合成。(文/图李唐)