2018年5月8日,硕士研究生谢尚强和何金霞同学在组会上做了文献报告,具体内容如下:
报告人:谢尚强报告题目:Structures of humanO-GlcNAcase and its complexes reveal a new substrate recognition mode
报告内容:人O-GlcNAcase(hOGA)是负责水解O-连接的N-乙酰葡糖胺(O-GlcNAc)修饰的唯一酶,调节许多细胞蛋白质响应于营养物质和压力有关的必需蛋白质糖基化事件。主要报告了截断体hOGA晶体结构,以及与抑制剂复合物和糖肽底物复合的共结晶。作者发现hOGA形成了一种独特的臂中同型二聚体,其中一个单体的催化结构域被姐妹单体的茎结构域覆盖,产生底物结合裂缝。裂隙表面上的残基提供了与肽底物的广泛相互作用,这种识别模式与其细菌同源物不同。同时糖肽底物复合物共结晶的研究方法,为今后解决其他糖肽或糖蛋白复合物结构提供了一种新思路。
Figure 1Overall structure of OGA and the construct used. (a) Schematic of thereversible O-GlcNAcylation reaction catalyzed by OGT and OGA.
Figure 2Dimerization of OGA. (a) Two different views of the dimerizationinterface in the OGAcryst structure.
Figure 3Structure of OGAcryst in complex with thiamet-G.
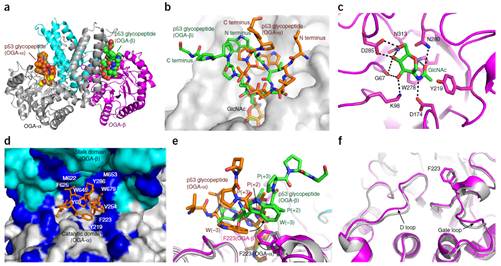
Figure 4Structure of the OGAcryst–p53 complex.
报告人:何金霞 报告题目:Degradationpathway of plant complex-type N-glycans: identification and characterization ofa key α1,3-fucosidase from glycoside hydrolase family 29
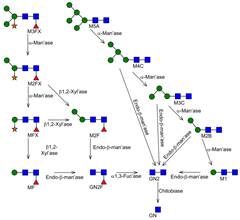
报告内容:到目前为止,植物复杂的N-聚糖降解通路仍未被完全阐明,主要是因为编码降解的酶的基因未被完全鉴定和表征;其中以M5A和M3XF为代表的降解通路中,水解M3XF 中的α1,3-Fuc的α1,3-fucosidase还未被鉴定,其底物特异性还未被检测。目前已经检测到来自植物来源岩藻糖苷酶只有两个:α1,2-岩藻糖苷酶和α1,3/ 4-岩藻糖苷酶。 其中α1,2-岩藻糖苷酶是水解半乳糖上链接的α1,2-岩藻糖;而α1,3/ 4-岩藻糖苷酶作用于植物复合型N-聚糖的LewA表位中的α1,4-岩藻糖苷键,且对M3F/M3FX/M2FX/MFX底物的α1,3-岩藻糖苷键不起作用。因此,作者假设拟南芥中由At2g28100编码的α1,3/ 4-岩藻糖苷酶( GH29家族),其能够水解具有Fucα1-3GlcNAc连接的这种特定的N-聚糖结构 (GN2F) ,并对其底物特异性等进行分析,证明了假设。
1.A图是从拟南芥中克隆表达的得AtFuT1,其大小为58kDa, 和预测的相符,B图对其体外活性进行液相验证,液相结果表明其具有水解α1,3-岩藻糖苷键的作用。

Figure1.Expressionand purification of recombinant AtFUC1. (A) SDS–PAGE of the purifiedrecombinant AtFUC1 (lane 1) and the Endo H-treated AtFUC1 (lane 2). (B)α1,3-Fucosidase activity of the purified AtFUC1 with 3FL-PA. The substrate,3FL-PA, gave a single peak (upper panel). Hydrolysis of 3FL-PA with AtFUC1 gavelactose-PA as an enzyme product (lower panel).
2. 表1是AtFuT1对来自动物和植物的底物进行底物特异性研究,结果表明AtFuT1能水解动物中α1,3-岩藻糖苷键和α1,4-岩藻糖苷键的底物,对α1,2-岩藻糖苷键的底物不起作用,对植物中的M3F/M3FX/M2FX/MFX底物的α1,3-岩藻糖苷键不起作用,但GN2F的底物起作用。
3.对酶学性质进行分析,结果表明最佳pH5.0,Km 为0.35 ± 0.06 mM,kcat 为2.0 ± 0.1 sec-1。
FigureS2.Biochemical characterization of AtFUC1. (A) pHdependence of AtFUC1. The activity at pH 5.0 was taken as 100 %. Enzymeactivity was measured using GN2F-PA as a substrate. (B) Stability of AtFUC1after pre-incubation for 2 h at 37 ºC with each buffer. The value obtained withpH 6.0 was taken as 100 %. (C) A Michaelis-Menten plot of AtFUC1 on GN2F. TheKm, and kcat values of AtFUC1 for GN2F were calculated as 0.35 ± 0.06 mM and2.0 ± 0.1 sec-1, respectively. (D) A Lineweaver-Burk plot of AtFUC1 on GN2F.
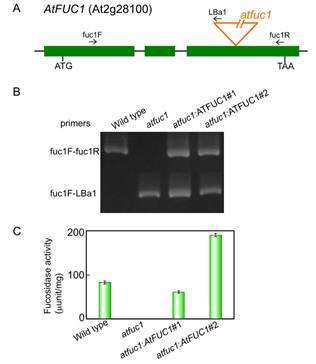
4.对植物(拟南芥、水稻和番茄)和细菌(拟杆菌)中的AtFuT1进行序列对比,结果表明,在细菌中保守的氨基酸残基在植物中也保守。

5.通过上述实验解释了N-聚糖降解通路图。
6.对AtFuT1缺失突变进行生物学功能研究,结果表明其突变后失去酶活力。
7.对AtFuT1缺失突变根长进行测定,结果表明突变后对拟南芥根生长无影响。

8.对AtFuT1缺失突变及突变怀复体叶中N-聚糖进行分析,结果表明突变后N-聚糖降解发生阻碍,其作用底物GN2F显著积累,且总糖含量也上升。

9.对AtFuT1缺失突变及突变怀复体叶中总蛋白和降解通路其他酶活进行分析。